Basic HTML Version
陈丽静等
, 2011,
百合
SRAP-PCR
反应体系的建立与优化
,
分子植物育种
Vol.9 No.24 (doi: 10.5376/mpb.cn.2011.09.0024)
1176
35 cycles
,最后
72
℃
5 min
,
4
℃保存。从图
6
中可
以看出能够扩增出清晰稳定的条带,并有较好的多
态性。
1.7 SRAP-PCR
体系及反应参数的稳定性检测结果
选择
SRAP
引物组合
me9+em8
进行
PCR
,
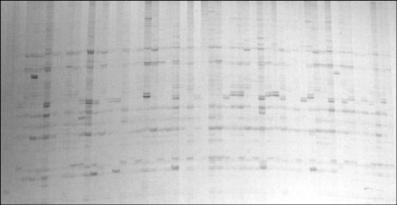
电泳结果如图
7
所示,所选择的引物能扩增出清
晰、重复性好的条带,表明优化的反应体系参数
稳定可靠。
图
7
引物
me9+em8 SRAP
的扩增结果
Figure7 The SRAP result with primer me9+em8
2
讨论
研究表明,不同种的试验材料
PCR
扩增反应体
系和扩增程序不同,大多数研究者进行
SRAP
研究
时都会都会对
PCR
扩增反应体系与扩增程序进行优
化,但是通常他们的优化方法都是采用正交实验的
方法
(
杨琦等
, 2007;
王振国
, 2007;
郭大龙
, 2008)
。
正交实验的优点为:完成试验要求所需的实验次数
少,数据点的分布很均匀,可用相应的极差分析方
法、方差分析方法、回归分析方法等对试验结果进
行分析,引出许多有价值的结论。但是其缺点也很
明显,即有可能得到的实验条件并不是最优条件。
所以本试验在确定了模板浓度和引物浓度后,主要
采用二因素方法确定剩下的反应条件。虽然会加大
一定的工作量,但得到的结果也更加准确可靠。
SRAP
是一种不需要内切酶消化的分子标记技
术,通常适宜植物
PCR
的模板
DNA
量为
1-100 ng
。
SRAP
的产生是由于遗传材料的基因组
DNA
在特定
引物结合区域产生
DNA
片段的插入、缺失或碱基突
变后可能导致
PCR
产物增加、缺少或发生变化,产
生特异的条带。因此微量的
DNA
差异也可能导致
PCR
产物的变化。汪小全等
(1996)
认为模板浓度在
一个相当大的范围内不影响扩增结果,而模板降解
程度则会对
SRAP
的结果产生影响。本试验支持汪
小全等的观点。
目前在
SRAP-PCR
中使用
2
种扩增程序。第
1
种
由
Li
等
(2001)
提出的即最初
5
个循环的退火温度设
为
35
℃。后
30
个循环的退火温度升高为
50
℃。第
2
种是
Budak
等
(2004)
提出的:
94
℃变性
1 min
,
47
℃
退火
1 min
,
72
℃延伸
1 min (35
个循环
)
,
72
℃
5 min
。
本试验采用了在一个循环体系采用一低一高两个
不同退火温度,扩增效果较为理想。
关于
SRAP
的反应体系和程序优化的报道
(
任羽
等
, 2004;
武志朴等
, 2005)
很多,其中模板
DNA
、
Mg
2+
浓度、引物浓度、
dNTPs
、
TaqDNA
聚合酶等
各组分的用量会影响扩增结果。本试验在优化
SRAP
扩增体系时发现,
Mg
2+
、引物、
dNTPs
、
Taq
DNA
聚合酶作为
SRAP
扩增的底物,有一个相对适
宜的用量范围,浓度过低,不能满足扩增要求;浓
度过高,组分间可能会产生竞争,降低各组分的活
性
,
影响扩增效果。因此,构建同一物种在相同仪器
设备和一定操作规范下的最佳的优化技术体系是
进行
SRAP
研究的关键所在。
3
材料与方法
3.1
试验材料
亲本材料:采用实验室胚培养的
“
雷山一号
”
与
“
晶体
”
做为父母本材料低温冰箱保存备用。
群体材料:采集
180
株
RIL
群体新生幼嫩叶片
低温冰箱保存备用。
3.2
基因组
DNA
的提取
参照黄永芳等
(2006)
提出的改良的
CTAB
法提
取百合群体基因组
DNA
。用紫外分光光度计测定
DNA
样品的质量和浓度,并于
1%
琼脂糖凝胶检
测。最后将纯化后的
DNA
稀释到
200 ng/μL
用于
后续试验。
3.3 PCR
反应
PCR
反应在
BIO-RAD
公司的
PTC
-
100 PCR
仪
中进行,扩增程序为:
94
℃ 预变性
5 min
,
94
℃
1 min
,
34
℃
1 min
,
72
℃
1 min
,
5 cycles
,
94
℃
1 min
,
50
℃
1 min
,
72
℃
1 min
,
35 cycles
,最后
72
℃
5 min
,
4
℃
保存。
PCR
反应总体积是
15 μL
。
PCR
产物采用
6%
变性聚丙烯酰胺凝胶电泳,
Na
2
CO
3
银染法染色显
影,在荧光灯上观察分析条带。

